十年答卷: 中国医药行业“7.22改革”迈向“质量为王”
- 2025-07-23 21:27:58
- 594
(人民日报健康客户端记者 石梦竹)“今天对于医药研发界是个大日子。”7月22日,中国医学科学院肿瘤医院副院长、中国医学科学院临床研究(GCP)平台建设首席专家李宁向人民日报健康客户端记者表示,自2015年“7.22”改革以来的十年,是中国医药产业破茧成蝶的十年。
2015年7月22日,国家药监局发布《关于开展药物临床试验数据自查核查的公告》(第117号文),1622个临床试验项目被要求限期自查,80%的注册申请主动撤回。对于这场被称为“7·22”的改革,李宁表示,从刀刃向内、自我剖析的公开透明到真诚、创新,医药研发界完成了一份中国医药产业从“野蛮上市”到“质量为王”的“成绩单”:
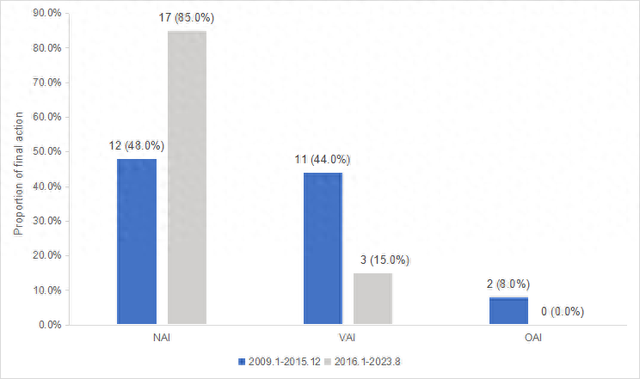
首先是临床试验质量跨越式提升,国内临床试验现场核查通过率从改革初期的不足20%升至2023年的85%。在2016至2023年美国食品和药品管理局(FDA)核查中国机构的结果中,零次出现OAI(严重问题,需要采取官方措施)结果,且检查结果排在前列,赶超欧美等发达国家。生物等效性(BE)试验数据实现国际互认“零的突破”,为创新药研发筑牢根基。
2009-2015与2016-2023年国内临床试验接受FDA现场核查结果对比,“无需采取行动”(NAI)比例显著提升
在创新方面,李宁表示,2015-2024年,中国自主研发创新药临床试验申请(IND)数量增长12倍,PD-1单抗、CAR-T细胞治疗等前沿领域实现全球同步研发。首个国产PD-1单抗、HPV疫苗、PARP抑制剂等标志性新药获批,让肺癌、乳腺癌等恶性肿瘤年治疗费用从30万元降至3万元以下,肝细胞癌、鼻咽癌等中国高发癌种告别“缺医少药”。
在影响力上,中国已从全球药物研发的“旁观者”变为“重要参与者”。李宁介绍,国产新药泽布替尼、特瑞普利单抗凭借中国临床数据获美国FDA批准,实现“中国数据、全球认可”;参与国际多中心临床试验的数量年均增长15.7%。
产业生态也在持续优化。2024年首次获批的创新药中,国产占比达42%(2015年不足10%);生物医药领域融资额从2015年的不足百亿元人民币跃升至2023年的千亿规模,本土药企对外授权(License-out)总额突破500亿美元。
新药临床试验申请由“审批制”转为“备案制”、中国临床研究与全球同步修订、接受境外临床试验数据、鼓励以临床价值为导向的新药研发……我国不断出台与时俱进、具备国际水平的监管举措,药政部门“周末作业”的方式,以及不断推出的各类领性规范和技术指导原则,也在推动医药产业发展。
创新药物研发的行业发展,也同步推动了医学进步,惠及全民健康。“十年来全行业的不懈努力,把中国变成了创新的沃土。未来也一定要牢记真实、质量、科学和开放的初心。”李宁说。
- 上一篇:孙颖莎分领跑世一
- 下一篇:严浩翔给链子南宫问雅摸头